Plastid-to-nucleus communication under hypoxia involves group VII ethylene response factors in Arabidopsis thaliana
2026年1月15日,德国慕尼黑大学的Melanie V. Leger-Paula和Peter Geigenberger及其合作者在PNAS上发表题为 “Plastid-to-nucleus communication under hypoxia involves group VII ethylene response factors in Arabidopsis thaliana”的研究论文。该研究就此展开深入探索,揭示了SAD6连接质体脂肪酸代谢与质体-细胞核逆向信号传导的关键作用。

研究发现,SAD6过表达的拟南芥植株与过表达稳定型Δ13RAP2.12(缺失N端13个氨基酸,不会被蛋白酶体降解)的植株表型高度一致,均表现出类囊体结构显著受损、脂质组成改变、叶绿素含量降低、光合作用效率下降及淀粉积累减少等特征,且这些表型在幼叶和中年叶中更为明显。而在Δ13RAP2.12过表达植株中通过人工microRNA沉默SAD6(SAD6-miR)后,上述异常表型几乎完全恢复为野生型,表明SAD6是塑造RAP2.12失调植株生长表型的关键因子。进一步研究显示,SAD6沉默不仅在Δ13RAP2.12过表达背景下,还在野生型植株缺氧处理条件下,显著减弱了ADH1、HB1、AlaAT1等重要缺氧响应基因的表达,导致植株缺氧存活率显著下降;相反,SAD6过表达则能提高植株的缺氧存活率,证实SAD6在激活 RAP2.12介导的缺氧响应中具有关键信号功能。机制层面,通过GFP报告载体实验证实,SAD6能够促进RAP2.12从质膜转移到细胞核,这一过程与SAD6 提高质体中C18:1/C16:0 脂肪酸比例密切相关——SAD6将C18:0脂肪酸转化为C18:1脂肪酸,后者经LACS酶催化生成 C18:1-CoA,C18:1-CoA 与质膜上的 ACBP 蛋白结合,促使RAP2.12从ACBP-RAP2.12 复合物中解离并进入细胞核,且该过程不依赖于细胞内ATP/ADP比率的变化。此外,SAD6的表达受RAP2.12调控,形成正向反馈循环,在缺氧条件下持续强化缺氧响应基因的表达,同时SAD6介导的脂肪酸去饱和还能增强膜的稳定性,帮助植株应对缺氧后的氧化应激损伤。
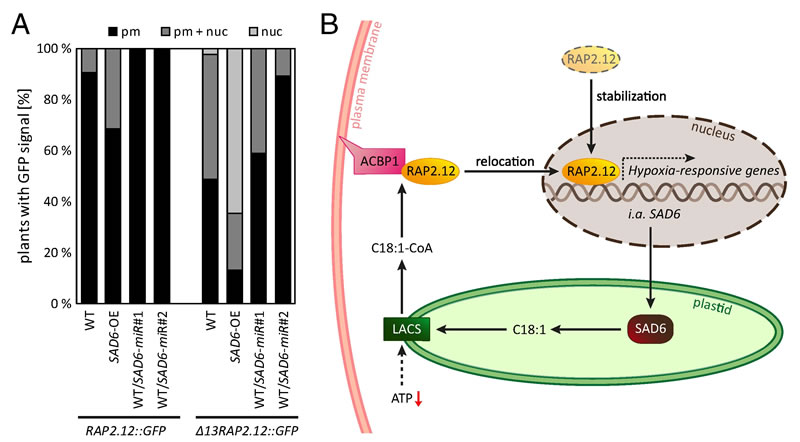
图1 SAD6在缺氧响应中调控RAP2.12核定位的机制示意图。通过GFP报告载体实验显示SAD6过表达促进RAP2.12向细胞核转移,包括RAP2.12::GFP和Δ13RAP2.12::GFP在WT、SAD6-OE及WT/SAD6-miR植株中GFP信号在质膜(pm)、细胞核(nuc)或两者同时存在的比例量化结果
该研究的核心价值在于首次明确了质体定位的SAD6在缺氧信号通路中的双重角色:既是 RAP2.12的下游靶基因,参与缺氧响应的执行,也是调控RAP2.12核定位的上游信号组件,为质体功能参与缺氧信号传导提供了直接证据,填补了相关研究领域的空白。此前研究认为 Δ13RAP2.12过表达导致的生长抑制与淀粉消耗相关,而本研究纠正了这一认知,证实其主要由SAD6过量表达引发的叶绿体脂质组成紊乱和光合作用受损所致。值得注意的是,SAD6在缺氧环境中能增强植株耐受性,但在常氧条件下过量表达会抑制生长,这提示植物需通过N-degron途径等严格调控SAD6的活性,以平衡缺氧适应能力与正常生长发育。该发现不仅深化了对植物缺氧响应分子机制的理解,还为培育耐洪涝胁迫的作物提供了潜在的分子靶点,后续可进一步探究SAD6在不同作物中的功能保守性及其在农业生产中的应用前景。
本研究中,使用德国WALZ公司M系列IMAGING-PAM叶绿素荧光成像系统测量拟南芥植株光系统II叶绿素荧光产率。正午时分,将五周龄土壤栽培植株暗适应30分钟,随后施加饱和脉冲测量光系统II最大量子产率(Fv/Fm)。延迟40秒后,以生长光强度的光照照射植物,并在10分钟内每20秒测定一次叶绿素荧光产率。计算PSII光下的实际量子产率Y(II),调节性和非调节性能量消散的量子产率Y(NPQ)和Y(NO)。
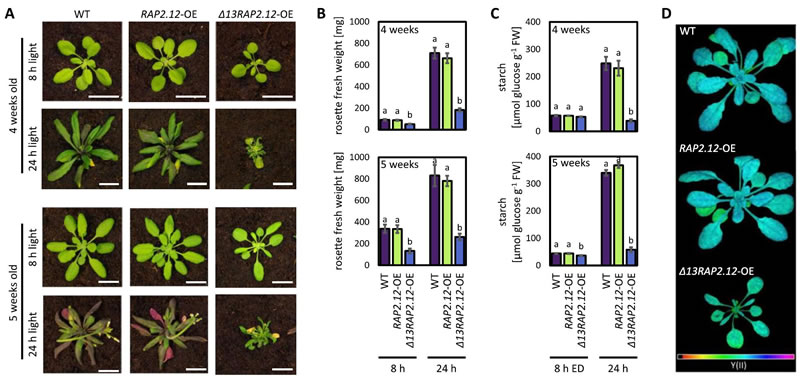
图2 Δ13RAP2.12过表达(OE)植株的生长扰动随时间推移和日照时长延长而加剧。S1光系统II荧光参数(Y(II)、Fv/Fm)
Acclimation to high and low diurnal light is flexible in Chlamydomonas reinhardtii
2026年1月2日,美国加州大学伯克利分校的Sabeeha S. Merchant教授团队及其合作者在PNAS发表题为 “Acclimation to high and low diurnal light is flexible in Chlamydomonas reinhardtii” 的研究论文。本研究通过对同步培养的莱茵衣藻群体进行系统分析,探究了弱光适应群体转入强光环境、强光适应群体转入弱光环境后的适应机制,为理解光合微生物的环境适应策略提供了新视角。

研究发现,莱茵衣藻在昼夜光照强度突变时展现出极强的适应灵活性。弱光适应的细胞转入强光环境后,虽在最初6小时经历了严重的光损伤,PSII最大光化学效率(Fv/Fm)从0.67±0.02 骤降至0.16±0.07,但在当天下午就能恢复叶绿体的形态和功能,并在夜间成功分裂;相比之下,强光适应的细胞转入弱光环境后,第一天几乎无法增大体积,也不能完成细胞周期,生长受到明显抑制,但两者均能在两天内完成重新适应。在结构层面,弱光适应的细胞转入强光后6小时内,类囊体膜堆叠程度显著降低,叶绿体出现肿胀迹象,这种结构变化可能为PSII修复机制提供了接触受损复合体的通道,助力光合功能恢复。
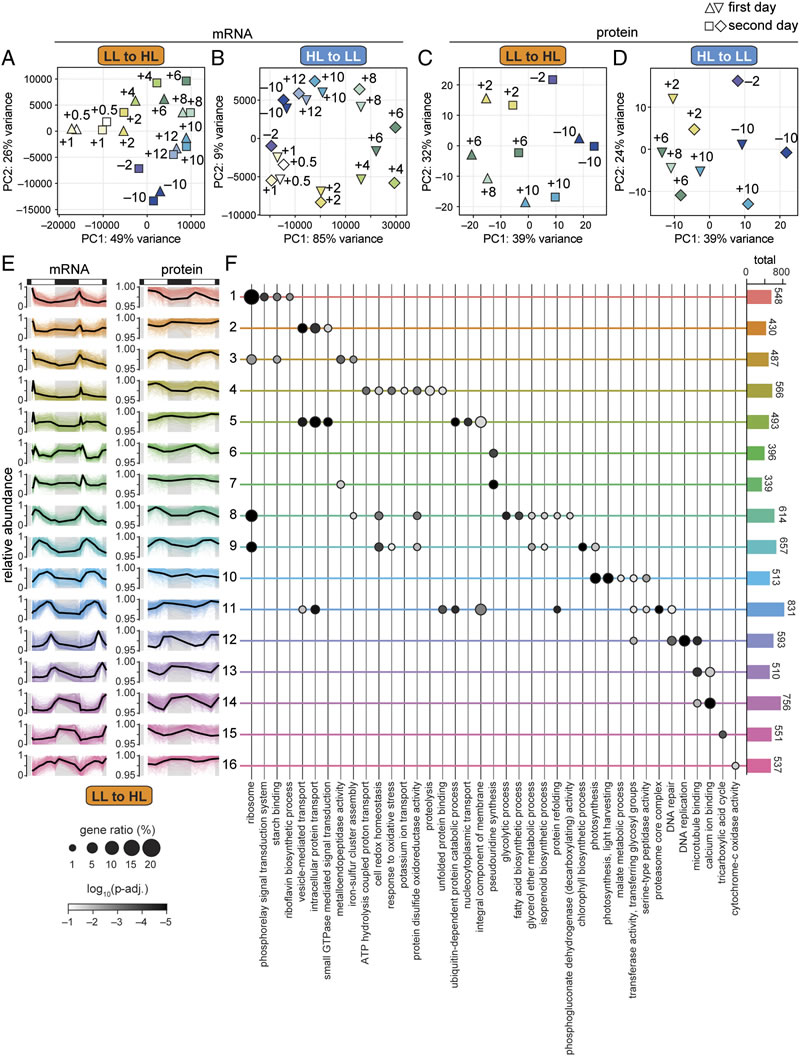
图3 通过主成分分析(PCA)展示了基因表达的整体特征,A、B图分别为弱光转强光、强光转弱光转录组的PCA分析(第一天样本为三角形,第二天样本为正方形/菱形,按昼夜时间着色标注),C、D图为对应蛋白质组的PCA分析,E图展示了16个共表达基因簇的mRNA和蛋白质积累模式(丰度相对于每个基因的最大值进行归一化,彩色线为单个mRNA和蛋白质的相对丰度,黑色线为平均相对丰度),F图为各基因簇中代表性基因本体(GO)术语的富集情况(点大小表示该GO术语在簇中基因的比例,点的深浅表示富集的log10 (P-adj.),右侧柱状图为每个簇的基因总数)。
分子层面的分析揭示了莱茵衣藻快速适应的核心调控网络。转录组和蛋白质组数据显示,弱光转强光后,细胞在光照初期就快速诱导了数千个基因的表达,包括编码蛋白酶、分子伴侣以及参与叶绿体未折叠蛋白反应的相关基因,这些基因的表达为细胞维持氧化还原稳态、蛋白质稳态提供了保障。光保护机制也迅速启动,弱光适应细胞在转入强光后,LHCSR家族基因(参与能量依赖型非光化学淬灭qE)被强烈诱导,LHCSR蛋白持续积累,非光化学淬灭(NPQ)能力从第一天+2时的0.31±0.12提升至+10时的0.70±0.13,夜间已达到长期强光适应细胞的水平;同时,玉米黄质积累、状态转换等光保护机制也在2小时内被激活,共同缓解了光损伤。此外,光合系统相关基因的表达呈现动态调整,强光环境下光合系统和天线蛋白的转录本丰度在初期下降,蛋白质丰度随后协同降低,而PSII核心亚基则通过短暂的合成增强来支持修复过程,这种转录和翻译水平的精细调控确保了细胞在光照突变后的能量吸收与利用平衡。
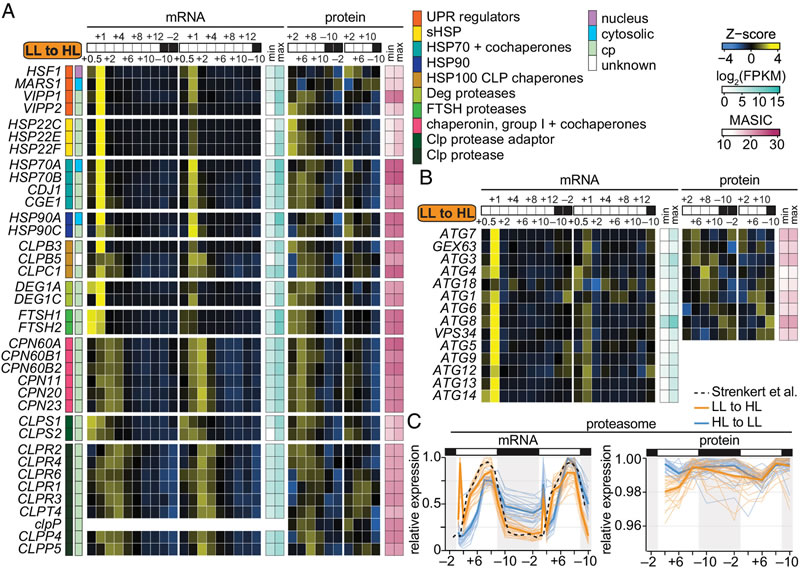
图4 弱光适应细胞转入强光后伴侣蛋白、蛋白酶和自噬通路的快速诱导,A图为参与叶绿体蛋白质稳态的mRNA和蛋白质变化(采用Z分数展示丰度模式,同时标注了最小和最大FPKM及MASIC值,蛋白质定位依据相关综述),B图为自噬相关mRNA和蛋白质的变化(展示方式同A图),C图为昼夜转换过程中蛋白酶体基因的表达(与中等光照适应细胞的参考数据对比,细线为单个mRNA和蛋白质的平均相对丰度,粗线为所有检测到的mRNA 或蛋白质的平均丰度)。
该研究不仅证实了莱茵衣藻在昼夜光照波动中强大的适应能力,还揭示了结构重塑、基因表达重编程与光保护机制协同作用的适应策略。值得注意的是,莱茵衣藻的昼夜节律基因表达程序在强光胁迫下仍能维持,强光诱导的广泛转录变化在修复光损伤的同时并未破坏其固有的昼夜节律,这种节律稳定性与应激灵活性的平衡,可能是其在复杂光照环境中存活的关键。未来研究可进一步探究在昼夜周期不同时间点或细胞周期不同阶段,莱茵衣藻对光照强度变化的适应能力差异,以及自噬、蛋白质稳态通路和VIPP蛋白在叶绿体形态功能恢复中的具体作用,为深入理解光合生物的环境适应进化提供更多依据。
本研究中,莱茵衣藻叶绿素荧光测定采用MAXI-IMAGING-PAM (Heinz Walz GmbH, Effeltrich, Germany)叶绿素荧光成像系统完成。光系统II最大量子效率(Fv/Fm)在细胞暗适应15min后测量。测定非光化学淬灭NPQ时,将12mL培养液移入50mL烧杯,以180 rpm振荡防止缺氧。细胞暗适应30min后,用远红光照射10min诱导光相细胞进入状态1或用远红光照射5min暗相细胞进入状态1。使用注射器将细胞沉积于玻璃纤维预滤膜上,并将滤膜置于用HS培养基润湿的Whatman滤纸上以防干燥。采用MAXI-IMAGING-PAM叶绿素荧光成像系统测量光曲线(Light Curve),增益设为15,阻尼设为5,光强与频率测量均设为1。Fv/Fm值采用饱和脉冲测量(强度Int.=10,脉冲宽度Winth=12, 0.72s(12*60ms=720ms))。分别施加50、180、550、970和1490 µmol m-2s-1强度的光照处理5分钟,并在每次处理后测量光适应状态下的Fm'值。非光化学非淬灭按公式NPQ=(Fm–Fm’)/Fm'计算,并记录各样本的最大NPQ值。
原 文
M.V. Leger-Paul, et al. Plastid-to-nucleus communication under hypoxia involves group VII ethylene response factors in Arabidopsis thaliana[点击阅读原文]. Proc. Natl. Acad. Sci. U.S.A. 2026, 123 (3) e2525801123.
S. Dupuis, et al. Acclimation to high and low diurnal light is flexible in Chlamydomonas reinhardtii[点击阅读原文]. Proc. Natl. Acad. Sci. U.S.A. 2026, 123 (1) e2523996123.
